коррозия
Что такое коррозия
В общем, коррозия может быть определена как «воздействие материала на химическое, электрохимическое или износ в результате металлургического взаимодействия материала с окружающей средой». Входящий, это происходит медленно, но постоянно. В некоторых случаях коррозионные эффекты возникают только при окрашивании металла в виде тонкой клейкой пленки и могут оказывать последующее антикоррозионное действие. В большинстве случаев корродированный продукт имеет крупную и пористую поверхность и не защищен.
Коррозия, которая является одной из важнейших проблем отрасли, ежегодно наносит ущерб отрасли на миллиарды долларов. Несмотря на большое знание предмета, коррозия является сложной проблемой, и, несмотря на обширные исследования, многое еще предстоит изучить. В некоторых случаях, таких как прямые химические воздействия, коррозия может стать неизбежной.
Основной причиной коррозии является нестабильность металлов в чистом виде. Металлы всегда имеют тенденцию возвращаться к своим формам в природе.
Электрохимические принципы
Коррозия - это электрохимический процесс, вызванный преобразованием части или всего металла из металлического в ионный. Коррозия требует наличия тока между определенной поверхностью металла и стороной электролита. Электролит - это любой раствор, содержащий ионы. Например, чистая вода содержит одинаковое количество положительно заряженных ионов водорода (H +) и отрицательно заряженных ионов гидроксила (OH-).
В этом случае электролит может представлять собой обычную воду, рассол или кислоту или любые конденсированные щелочные растворы. Для завершения электрического тока всегда нужны два электрода, один анод, а другой катод, и они должны быть подключены. Электроды могут представлять собой два разных металла или две разные области на одном и том же металле. Соединение между анодом и катодом достигается через металлический мост и, как правило, с помощью простого контакта. Для возникновения электрического тока между электродами должна быть разность потенциалов.
|
|
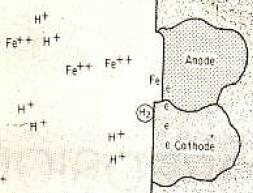
Если мы помещаем простой кусок железа в раствор соляной кислоты, мы наблюдаем образование плотного газообразного водорода. На поверхности металла имеются многочисленные мелкие анодные и катодные области, вызванные остатками, называемыми незначительными включениями, неровностями поверхности, различными проявлениями напряжений, областями и различными ориентациями ячеек или изменениями условий окружающей среды. Эти условия схематически показаны на рисунке 1.
Со стороны анода положительно заряженные атомы железа выходят из поверхности и смешиваются с раствором в виде положительно заряженных ионов, тогда как атомы в форме отрицательно заряженных электронов остаются в металле. Электроны встречаются и нейтрализуют положительно заряженные ионы водорода, которые выходят на поверхность через раствор электролита на стороне катода. Положительные ионы, потерявшие заряд, становятся нейтральными атомами и взаимодействуют с газообразным водородом.
Таким образом, по мере продолжения процесса окисление и коррозия железа происходят на стороне анода, а выход водорода - на стороне катода. Соотношение растворенного металла прямо пропорционально числу образовавшихся электронов в зависимости от прочности и потенциала металла. |
|
Рисунок 1: Ионы в аноде в формировании маленькой региональной ячейки и схематическое изображение образования водорода в катоде |
|
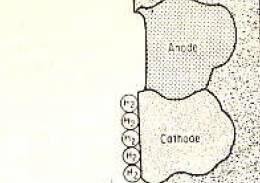
Поляризация регионального катода со слоем водорода
|
Для продолжения коррозии необходимо удалить коррозионные слои с анода и катода. В некоторых случаях образование газообразного водорода на катоде происходит очень медленно, а образование водородного слоя на поверхности металла замедляет реакцию.
Эта ситуация, показанная на рисунке 2, называется катотической поляризацией. Однако уровень растворенного кислорода в растворе электролита вступает в реакцию с водородом и достигает уровня с образованием воды, вызывая развитие коррозии.
Удаление этого слоя для железа и воды зависит от эффективной плотности растворенного кислорода, прилипшего к катоду в воде.
Эта эффективная плотность зависит от вентиляции, количества движения, температуры, количества растворенной соли и других факторов, соответственно. Продукты анодного и катодного процессов часто реагируют друг с другом в растворе и вызывают образование многих известных и видимых продуктов коррозии. |
|
Продукты анодного и катодного процессов часто реагируют друг с другом в растворе и вызывают образование многих известных и видимых продуктов коррозии.
Например, они сталкиваются с движением гидроксильных ионов в воде от катодных реакций железа к аноду через электролит и противоположным движением ионов железа. Эти ионы образуют гидроксид железа, так как он разлагается на рисунке-3.
Затем он вступает в реакцию с кислородом в растворе с образованием гидроксида железа (III), который осаждается и образует слой ржавчины из железа. В зависимости от щелочности, количества кислорода и перемешивания раствора, эта ржавчина образуется на поверхности вдали от поверхности железа или таким образом, что дополнительно влияет и усиливает процесс коррозии. |
|
|
Рисунок 3: Образование гидроксида железа при коррозии железа |
Факторы, влияющие на коррозию
|
Одним из наиболее важных факторов, влияющих на коррозию, является разность потенциалов, создаваемая различными металлами при соединении или вставке в раствор электролита. Этот потенциал обусловлен химической природой анотического и катотического регионов. Значения индикатора того, что некоторые металлы могут быть анодными по сравнению с водородом, приведены в стандартной таблице «Power-Motion Power Series» в таблице-1. Принимая значение стандартного водородного элемента к нулю, значения электродного потенциала металлов видны сравнительно. Эти значения приведены в порядке убывания. Более активные металлы демонстрируют более сильную тенденцию растворяться в растворе, чем металлы вверху списка, внизу списка. Серия Electro-Motion содержит только металлы в условиях, когда серия определена. Металлы, обработанные в растворах электролитов, содержащих солевой раствор, включены. В реальных условиях эксплуатации их поведение может отличаться в других растворах электролита. Вместо серии Electro-Motion аналогичные «гальванические серии» используются в эксперименте по составу металлов в широком диапазоне условий окружающей среды. Здесь «гальванический» - это значение, которое производит и использует электрический ток. В таблице 2 приведены примеры некоторых металлов и сплавов, движущихся с высокой скоростью в морской воде. Материалы в верхней части этого списка являются анодными и подвержены коррозии, в то время как материалы в нижней части списка имеют катодную и гальваническую защиту. Разница электрических потенциалов между двумя металлами связана с разницей между ними в гальваническом ряду. Объединение материалов близко друг к другу в гальваническом списке вызывает коррозию, которая происходит медленнее, чем те, которые находятся далеко друг от друга
Процесс промывки или смешивания влияет на увеличение скорости коррозии, поскольку он контактирует со свежим раствором коррозии с металлом. |
|
|
Стол - 1 |
Электро - Серия Силы Движения |
|||
|
Электродная реакция |
Стандартный электродный потенциал, E º |
Электродная реакция |
Стандартный электродный потенциал, E º |
|
|
K = K+ + e- |
-2,922 |
Co = Co++ + 2e- |
-0,277 |
|
|
Ca = Ca++ + 2e- |
-2,87 |
Ni = Ni++ + 2e- |
-0,250 |
|
|
Na = Na+ + e- |
-2,712 |
Sn = Sn++ + 2e- |
-0,136 |
|
|
Mg = Mg++ + 2e- |
-2,34 |
Pb = Pb++ + 2e- |
-0,126 |
|
|
Be = Be++ + 2e- |
-1,70 |
1/2H2 = H+ + e- |
-0,000 |
|
|
Al = Al3+ + 3e- |
-1,67 |
Cu = Cu++ + 2e- |
0,345 |
|
|
Mn = Mn++ + 2e- |
-1,05 |
Cu = Cu+ + e- |
0,522 |
|
|
Zn = Zn++ + 2e- |
-0,762 |
Ag = Ag+ + e- |
0,800 |
|
|
Cr = Cr3+ + 3e- |
-0,71 |
Pd = Pd++ + 2e- |
0,83 |
|
|
Ga = Ga3+ + 3e- |
-0,52 |
Hg = Hg++ + 2e- |
0,854 |
|
|
Fe = Fe++ + 2e- |
-0,440 |
Pt = Pt++ + 2e- |
1,2 |
|
|
Cd = Cd++ + 2e- |
-0,402 |
Au = Au3+ + 3e- |
1,42 |
|
|
In = In3+ + 3e- |
|
Au = Au+ + e- |
1,68 |
|
Определенные типы коррозии
Определение удельной коррозии обычно используется для конкретных видов коррозии в промышленных применениях. Когда вся поверхность металла подвергается коррозии с одинаковой скоростью, это называется равномерной коррозией. Этот тип коррозии не очень распространен в металлах, потому что очень редко металлы находятся в однородном состоянии.
Нуклеация (точечная) коррозия
|
|
|
Коррозия коррозии
|
Как видно из рисунка-5, он образован пузырьками и полостями, разрушающимися в жидкости. Подобно повторяющимся нагрузкам, прикладываемым к поверхности, вибрационное движение между поверхностью и жидкостью вызывает большие напряжения, когда эти пузырьки образуются регулярно и разрушаются или лопаются. Эти углубления или взрывы постепенно создают импульсы высокого напряжения, которые заставляют частицы разрушаться на поверхности и, в конечном итоге, оставляют ямы и вмятины. Нержавеющие стали имеют очень хорошую устойчивость к точечной коррозии. Однако устойчивость чугунных, бронзовых и стальных отливок к этому типу коррозии низкая. |
|
Декабрь (трещина) коррозия
|
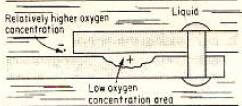
Склеивание двух металлов, подверженных воздействию коррозии, вызывает коррозию в зонах выдержки. Мы знаем, что небольшие зазоры в соединениях обычно содержат больше раствора, и эта влажность или сушка раствора занимает больше времени, чем в других регионах. Аналогично, эти интервалы вызывают коррозию при нормальных условиях эксплуатации, даже в жидкости или растворе. Как видно на рисунке 6, условия потенциала коррозии создаются из-за разности потенциалов в концентрации кислорода.
Кислород легко доступен снаружи соединения, который будет действовать как катодный наконечник в цепи. Часть внутри точки соединения будет служить анодом. Из-за постепенно уменьшающейся плотности кислорода в части между точкой соединения разность электрических потенциалов будет увеличиваться.
Если эта ситуация сохраняется, коррозия начнется со временем на стыке из-за уменьшения плотности кислорода. Коррозия всегда начинается там, где концентрация кислорода низкая. Разрывы и трещины также могут привести к различиям в плотности ионов металлов.
|
|
Коррозия износа
|
Это общий тип поверхностного износа, вызванного вибрацией, возникающей из-за удара, удара или трения на поверхностях с высоким соединением, поверхностях с высокой нагрузкой. Такая коррозия возникает в деталях, которые плотно прижаты или зажаты и работают при мгновенных переменных нагрузках. Абразивная коррозия повреждает зубчатые колеса, ухудшает их размеры и снижает их усталостную прочность.
Если два металла потрут, приложенные силы вызовут сваривание мелких частиц на поверхности. С продолжающимся движением эти маленькие частицы движутся, царапают поверхность и реагируют с атмосферой, чтобы сформировать частицы в форме пыли в соединении. На рисунке 8 вы можете увидеть коррозию износа вала в шестерне масляного насоса во время испытания на усталость. Есть много способов предотвратить износ коррозии.
Наиболее удобный способ - устранить вибрацию, вызванную жестким зажимом, или установить деталь таким образом, чтобы она не вызывала больше вибрации. Некоторые из других методов; Чтобы увеличить твердость соединительных поверхностей, нанести резиновый элемент на соединения, которые будут поглощать движение, смазать в сухой среде, закрыть всю поверхность такими материалами, как резиновая начинка, чтобы отсоединить материал от атмосферы и т. Д. «Д-р
|
|
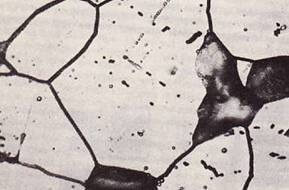
Межзерновая Коррозия
Это коррозия, которая возникает, когда сплавы (или ячейки) имеют разность потенциалов в сплавах. Такая коррозия обычно происходит с образованием другой фазы, которая осаждается в твердом растворе. Поскольку образование отложений на границах зерен происходит намного быстрее, области вокруг границ зерен заполняются растворенным элементом, и границы клеток исчезают до определенной степени. (См. Рис. -9). Если смотреть поверхностно, повреждение может быть не полностью видимым, и в большинстве случаев происходит заметное снижение механических свойств.
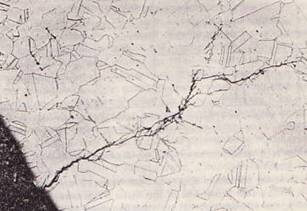
Стресс (или Стресс) Коррозия
Это тип коррозии, которая возникает в некоторых условиях окружающей среды из-за внешних напряжений металлов или внутренних напряжений, оставшихся после холодной прокатки. Результирующее растрескивание может быть в форме межзернового или зернистого или в комбинации обоих. Величина напряжения, вызывающего растрескивание, зависит от окружающей среды, вызывающей коррозию, и структуры основного металла.
Коррозия под напряжением является очень важным типом коррозии, так как она может возникнуть во многих металлах. Хотя почти все металлы подвержены воздействию коррозии под напряжением, состояние, которое создает трещины или трещины для одного металла, может не оказывать естественного влияния на другой металл аналогичным образом. Поэтому трудно точно предсказать, где это произойдет. Азот, содержащийся в стали, делает сталь подверженной коррозионному растрескиванию в некоторых растворах нитратов.
Стали, содержащие алюминий, более устойчивы к коррозионному растрескиванию под напряжением, так как алюминий реагирует с азотом с образованием нитрата алюминия. Некоторые нержавеющие стали более подвержены коррозионному растрескиванию под напряжением в средах, содержащих хлорит, таких как хлорит натрия, такой как хлорит кальция. Проблема коррозионного растрескивания является проблемой, возникающей при использовании аустенитных сталей в хлоритсодержащих средах. На рис. 10 показана трещина растяжения и коррозии аустенитной нержавеющей стали марки 304.
Ферритные нержавеющие стали более устойчивы к коррозии под напряжением, чем аустенитные или мартенситные нержавеющие стали. Стрессовая коррозия трещины значительно снижает механические свойства материала. Влияние некоторых видов коррозии на механические свойства материала можно увидеть в таблице 3.
|
|
|||||
|
Тип коррозии |
Потеря веса (%) |
Глубина проникновения (%) |
Потери в Свойствах (%) |
||
|
Ломая Мук. |
Течет мук. |
удлинение |
|||
|
сглаживать |
1 |
1 |
1 |
1 |
1 |
|
зарождение |
0,7 |
5 |
7 |
5 |
15 |
|
межзернистый |
0,2 |
15 |
25 |
20 |
80 |
|
напряжение |
0,1 |
100 |
100 |
100 |
100 |
|
|
|
|
|
|
Гальваническая Коррозия
В результате контакта двух металлов друг с другом в среде, склонной к образованию коррозии, он образуется на границе раздела, где они вступают в контакт.
 Pусский
Pусский